Benutzer-Werkzeuge
Seitenleiste
Flavine
Flavine sind die am weitesten verbreiteten organischen Kofaktoren von Proteinen [Reid, 2002Reid, G. A. (2002): Flavins, Flavoproteins and Flavoproteomics, in Chapman, S., Perham, R., Scrutton, N. (Hg.): Flavins and Flavoproteins 2002, S. 3, Rudolf Weber, Berlin, Ames, 2002Ames, Bruce N.; Elson-Schwab, Ilan; Silver, Eli A. (2002): High-dose vitamin therapy stimulates variant enzymes with decreased coenzyme binding affinity (increased Km): relevance to genetic disease and polymorphisms, American Journal of Clinical Nutrition 75:616-658, Massey, 1995Massey, Vincent (1995): Introduction: flavoprotein structure and mechanism, FASEB Journal 9:473-475, Massey, 2000Massey, Vincent (2000): The Chemical and Biological Versatility of Riboflavin, Biochemical Society Transactions 28:283-296]. Grund dafür ist die Vielfalt ihrer möglichen Redoxzustände: In biologischer Umgebung können sie voll reduziert, ein-Elektron-reduziert (Semichinon, Radikal) und voll oxidiert vorkommen. Das erlaubt ihnen, an einer Vielzahl biochemischer Reaktionen als Redoxkatalysatoren in Ein- und Zwei-Elektronen-Transferreaktionen teilzunehmen und insbesondere zwischen der Zwei-Elektronen-Oxidation der meisten organischen Substrate und den Ein-Elektronen-Reaktionen der Atmungskette zu vermitteln [Massey, 2000Massey, Vincent (2000): The Chemical and Biological Versatility of Riboflavin, Biochemical Society Transactions 28:283-296]. Darüber hinaus agieren sie als Elektrophile oder Nukleophile und bilden häufig während der Katalyse kovalente Intermediate mit dem Substrat, aber auch mit dem Protein [Mewies, 1998Mewies, Martin; McIntire, William S.; Scrutton, Nigel S. (1998): Covalent attachment of flavin adenine dinucleotide (FAD) and flavin mononucleotide (FMN) to enzymes: The current state of affairs, Protein Science 7:7, Edmondson, 2001Edmondson, Dale E.; Newton-Vinson, Paige (2001): The Covalent FAD of Monoamine Oxidase: Structural and Functional Role and Mechanism of the Flavinylation Reaction, Antioxidants & Redox Signaling 3:789-806].
Jeder der drei Redoxzustände des Flavins hat ein charakteristisches UV/Vis-Spektrum (vgl. Abb. 1). Das erlaubt, mit Hilfe der optischen Spektroskopie den Redoxzustand des Flavins im Protein sicher zu bestimmen. Gleichzeitig kann anhand der Form charakteristischer Absorptionsbanden zwischen freiem und proteingebundenem Flavin unterschieden werden.
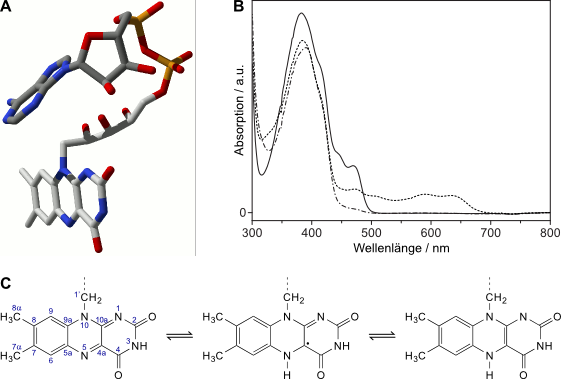
Abbildung 1: Der Flavinkofaktor der Photolyasen und Cryptochrome. (A): U-förmige Konformation des Flavinadenindinukleotids (FAD), wie sie in allen Photolyasen und Cryptochromen konserviert ist, hier aus Synechocystis sp. Cry-DASH, PDB ID 1NP7. (B, C): Die drei biologisch relevanten Redoxzustände von Flavin: (B) UV/Vis-Spektren der drei Redoxzustände von Flavin (proteingebunden, Xenopus laevis Cryptochrom-DASH): FADox (-), FADrad (- -) und FADred (-.-). Das Absorptionsmaximum bei 380 nm stammt vom zweiten Kofaktor des Proteins (MTHF). (C) Strukturformeln des 7,8-Dimethylisoalloxazinrestes des Flavins in seinen drei Oxidationszuständen: FADox (links), FADrad (mittig) und FADred (rechts). In FADox ist die Nummerierung der Atome nach IUPAC eingezeichnet. (A) wurde mit dem Programm spdbv [Guex, 1997Guex, N.; Peitsch, M.C. (1997): SWISS-MODEL and the Swiss-PdbViewer: An environment for comparative protein modeling, Electrophoresis 18:2714-2723] erstellt.
Jeder der Redox-Zustände existiert in einer kationischen, neutralen und anionischen Form, abhängig vom pH-Wert der Umgebung. Der voll oxidierte Redox-Zustand ist typischerweise der energetisch stabilste in Flavoproteinen.
Flavine absorbieren Licht im sichtbaren Wellenlängenbereich: Die optische Absorption des Grundzustands der Flavine liegt zwischen 400 und 500 nm. Zusammen mit der hohen Quantenausbeute für das Intersystem Crossing (ISC) und das hohe Oxidationspotential des Triplett-Zustandes ist diese Eigenschaft für die Photooxidation der Flavine verantwortlich.
Diese Eigenschaften sind ebenfalls Voraussetzung für die quantitative Generierung des Semichinon-Radikals und der Hydrochinon-Form der Flavine in Proteinen ausgehend vom voll oxidierten Zustand. Diese Photoreduktions-Reaktionen laufen typischerweise unter Blaulicht ab. Sie konnten auch ohne externe Elektronendonatoren in Proteinen, z.B. der DNA-Photolyase, beobachtet werden.
